II-1-(1) シトクローム酸化酵素での電子遷移とプロトン輸送
呼吸、光、食物摂取などによって生体内に導入されたエネルギーは、最終的に細胞内ミトコンドリアに運ばれ、そこで電子伝達系によって遊離され、ミトコンドリア内膜のプロトンの化学ポテンシャル差に変換され、その化学ポテンシャル差が合成酵素によるATP合成に用いられています。ミトコンドリア内膜のプロトンの化学ポテンシャル差を生み出しているのは、シトクロームc酸化酵素(Cytochrome c oxidase)とよばれる膜蛋白質です。そこでは、酸化還元反応に共役して、プロトンがミトコンドリア・マトリクスから膜間腔へ運ばれています。近年の構造生物学の進展により、シトクロームc酸化酵素の酸化型還元型双方での原子構造が明らかになってきました。それによると、H経路とよばれる新たなプロトン経路が見出され、これがプロトンの化学ポテンシャル差を生み出す経路であることが提唱されています。
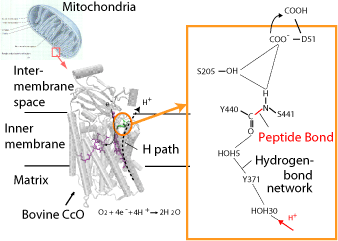 [図: シトクロームc酸化酵素中のプロトン移動経路:H 経路とよばれている。]
[図: シトクロームc酸化酵素中のプロトン移動経路:H 経路とよばれている。]
通常生体内でのプロトン移動は、水分子間の水素結合を介して比較的容易に行われます(Grotthuss機構)。H経路においても、この水分子を介したプロトン移動が重要ですが、その水分子の連なりは、蛋白質のペプチド鎖によって途切れています。こうしたペプチド鎖を横切るようなプロトンの移動が、どのような微視的過程によって可能になるのかについては、今まで殆ど何もわかっていませんでした。
当研究室では、密度汎関数法に立脚したミクロスコピックな理論計算により、シトクロームc酸化酵素での、ペプチド結合を介したプロトン移動の機構を明らかにしました。実際の原子構造の詳細な解析と、Car-Parrinello第一原理分子動力学計算から、エノール型からケト型への互変異性化がペプチド結合を介するプロトン移動の鍵となる過程であることがわかりました[Journal of Physcal Chemistry B: 110, 4443 (2006)]。その原子素過程は以下のようなものです。水分子の連なりを横切っている、Tyr440とSer441アミノ酸付近のペプチド結合は、安定なケト型構造を取っています。そこに、ミトコンドリア・マトリクス側からのGrotthuss機構によるプロトンの付加が起こり、それによってケト構造が不安定なイミド酸構造になり、さらには膜間腔側からのAsp51とSer205によるプロトン引き抜きによりエノール構造が出現し、このエノール構造のケト構造への互変異性化により、プロトン移動のサイクルが完結するというものです[Journal of Americal Chemical Society: 129, 9663 (2007)]。
計算で明らかになったもうひとつのポイントは、ペプチド鎖のターン構造の重要性です。上記Tyr440とSer441 のアミノ酸の隣にはAsp442 アミノ酸がいます。この部分のペプチド鎖は、X線回折実験によるとターン構造を有しています。このAsp442のペプチド結合を介した二段階の間接的互変異性化の可能性を調べてみると、直接的互変異性化に比べて、エネルギー障壁が19 kcal/mol 程低下することがわかりました。蛋白質の広い部分に渡る協力的原子素過程が、反応を促進しています。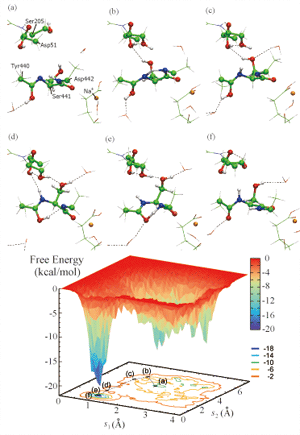 [図:H 経路のペプチド結合を横切るプロトン移動の素過程。エノール型構造からケト型構造への間接的互変異性化によって、プロトン移動のサイクルが達成されている。上図の素過程に対応した反応自由エネルギー。]
[図:H 経路のペプチド結合を横切るプロトン移動の素過程。エノール型構造からケト型構造への間接的互変異性化によって、プロトン移動のサイクルが達成されている。上図の素過程に対応した反応自由エネルギー。]




